
 |
L' avvento della teoria atomica permise di dare un' interpretazione teorica delle leggi empiriche che descrivono il comportamento dei gas:
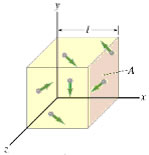
il volume rappresenta lo spazio disponibile per il moto delle
molecole; la pressione rappresenta la variazione
media della quantità di moto subita dalle molecole quando entrano in collisione
con le pareti del contenitore e vengono di conseguenza riflesse; la temperatura
è proporzionale all' energia
cinetica media delle molecole, cioè al quadrato della loro velocità
media. Vediamo l' esempio di un gas contenuto in un recipiente cubico il cui
spigolo è lungo l. Le particelle quando picchiano contro le pareti
del recipiente, ipotizzando di essere in condizione di gas
perfetto, variano la direzione della velocità che rimane però invariata
come modulo (urto elastico).

La variazione della quantità di moto sarà quindi:
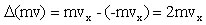
Di conseguenza la forza media esercitata sulla particella dalla parete è data dalla variazione della quantità di moto della particella nell' intervallo di tempo fra due urti consecutivi:
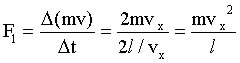
Si noti he non urta una sola particella contro la parte del recipiente, ma sono N le particelle ad urtare, e considerando che esse si muovono in tre dimensioni, mediamente quindi solo un terzo di esse colpisce la parete durante l' intervallo di tempo avremo che:
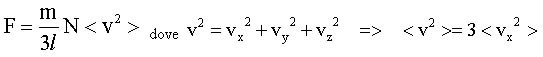
da qui si possono ricavare la pressione, l' energia cinetica e l' energia totale:
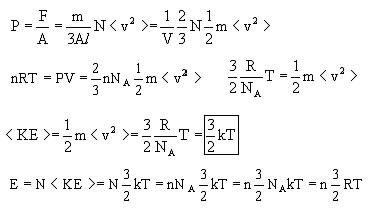
dove k è nota la Costante di Boltzmann.
La definizione di energia cinetica
Tutto quanto riportato in questa pagina è a puro scopo informativo personale. Se non ti trovi in accordo con quanto riportato nella pagina, vuoi fare delle precisazioni, vuoi fare delle aggiunte o hai delle proposte e dei consigli da dare, puoi farlo mandando un email. Ogni indicazione è fondamentale per la continua crescita del sito.